近日,南京三迭纪医药科技有限公司(下称“三迭纪”)宣布公司首个3D打印药物产品T19获得国家药品监督管理局(NMPA)的药物临床试验(IND)批准。该产品在中国按照2.2类改良型新药进行注册申报,是已知公开的首个在中国获得IND批准的3D打印药物产品。
三迭纪创始人、首席执行官成森平博士对《华夏时报》记者表示,T19产品在中国获得IND批准,是T19国际注册的一个里程碑。在审评和沟通过程中,我们感受到了CDE对于新兴制药技术的鼓励和支持。未来,我们将用先进的制药技术为中国患者带来更优临床价值和更高产品质量的药物。
突破
3D打印又被称为增材制造技术。目前,3D打印技术已应用于制药行业,为制药行业提供了新的设计思路和制造手段。
作为一项新兴技术,药物3D打印在药物设计、制造和使用药物的方式产生革命性转变。据介绍,3D打印药物是通过数字化制剂开发方法和独有的程序化释药技术,针对原研痛点进行改良,为患者提供更好的临床用药选择。
类风湿关节炎(rheumatoid arthritis, RA)是一种常见的慢性疾病,根据中美临床关键意见领袖(KOL)访谈意见,晨间症状仍然是困扰类风湿性关节炎患者的主要问题。由三迭纪自主研发的T19,根据时辰治疗学原理,针对类风湿性关节炎症状的昼夜节律进行设计,为患者提供更好的临床用药选择。患者睡前服用T19,血液中的药物浓度在疼痛、关节僵硬及功能障碍等疾病症状最严重的早晨达峰,并维持其日间血药浓度,从而取得最佳的药物治疗效果。
公开资料显示,T19是三迭纪自主设计开发的具有全球知识产权的3D打印药物,此前,T19在美国FDA通过505(b)(2)路径进行注册申报,于2021年获得IND,是已知公开的全球第二款在美国FDA注册申报的3D打印药物产品,也是首个在中国获得IND批准的3D打印药物产品。据三迭纪相关负责人透露,该产品接下来将分别在美国和中国开展临床研究,并向FDA和NMPA递交上市申请(NDA)。
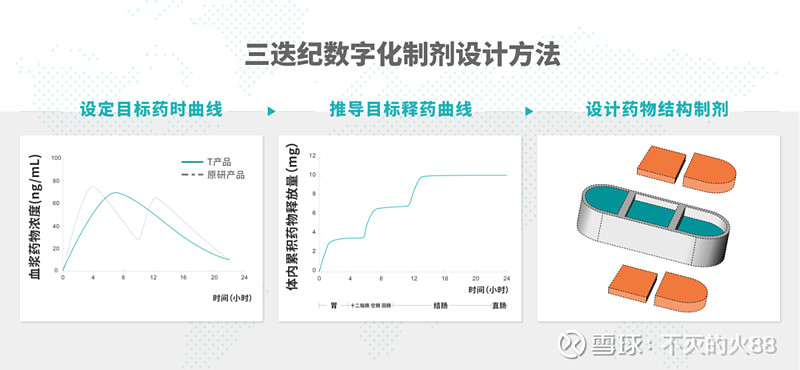
据悉,三迭纪开发了3D打印剂型源于设计(3D Printing Formulation by Design, 3DFbD)的数字化制剂开发方法,首先根据优化的目标药代动力学曲线,应用基于生理学的生物药剂学模型,根据文献人体参数,计算出体内不同时间和空间的目标释放曲线;然后根据该目标释放曲线,使用热熔挤出沉积(Melt Extrusion Deposition, MED)3D打印技术,设计并制备含有多腔室的药物结构制剂,实现释药的“3R”精准控制,即药物在正确的时间(Right time),以正确的剂量(Right amount),递送到人体正确的胃肠道部位(Right location),使得药物被有效吸收。
成森平对本报记者表示:“新兴制药技术从开发到应用,通常需要30年,3D打印制药已经走过26年。目前,全球共有四款注册申报的3D打印药物产品,三迭纪有幸贡献了其中三款。三迭纪全球T系列产品是针对全球重磅药物开发的改良产品。通过改良为患者和药企创造新的价值,为原研产品生命周期管理带来迭代产品,从而延长药物的生命周期,提高药物的商业价值。”
市场
弗若斯特沙利文《药物3D打印行业报告》指出,药物3D打印技术的主要应用领域将聚焦在小分子药物市场。同时,相较于传统固体制剂,药物3D打印技术能够更好地控制药物释放,提高药物疗效,减轻药物副作用,并且降低患者给药的频次。全球已有数款3D打印药物被获批进入到临床阶段,且分为规模化生产、个性化制药这两类方向。
报告称,“在技术应用方面,由于3D打印药物使用全新的制药技术,对于药物3D打印公司,需走通特定国家的法规路径保障产品未来实现商业化。对于监管机构,需要适应并接受3D打印作为药物的制造方式,并为新技术带来的变革做好准备。”
记者梳理发现,目前全球共有3款3D打印药物产品在FDA IND(临床试验批准)获批进入临床阶段,其中三迭纪就有2款,首个产品T19已于2021年1月获得美国FDA的IND批准;第二个产品T20于2022年3月获得美国FDA的IND批准;另外,第三个产品T21已于2021年12月获美国FDA PIND积极回复,有望成为全球第四款获批进入临床阶段的3D打印药物产品。
据悉,类风湿性关节炎在美国、中国等主要市场国家均有着巨大的临床和市场需求,《中国类风湿关节炎发展报告2020》显示,我国目前约有500万名类风湿关节炎患者,平均发病年龄只有45岁。有关预测显示到2025年,预计全球类风湿关节炎的市场规模将达到307亿美元(CAGR 4.5%)。
弗若斯特沙利文大中华区医疗组高级咨询总监李谦在此前接受本报记者采访时表示,“药物3D打印实现商业化价值,需要以终为始,从患者临床需求切入开发产品,之后需要走通特定国家的法规路径保障产品未来实现商业化。药物3D打印公司可以通过‘自主研发+合作研发’模式实现商业化,可走biotech模式,自主研发产品,许可产品商业化权益,也可并行走CRO模式,为需要开发高难度制剂的创新药或高度差异化的改良型新药的药企提供解决方案。”
中国首款3D打印药物产品三迭纪T19获NMPA药物临床试验( )
近日
© 国家药品监督管理局药品审评中心官网
T19是三迭纪自主设计开发的具有全球知识产权的3D打印药物
类风湿性关节炎在美国
此前
三迭纪创始人
知之既深

。












