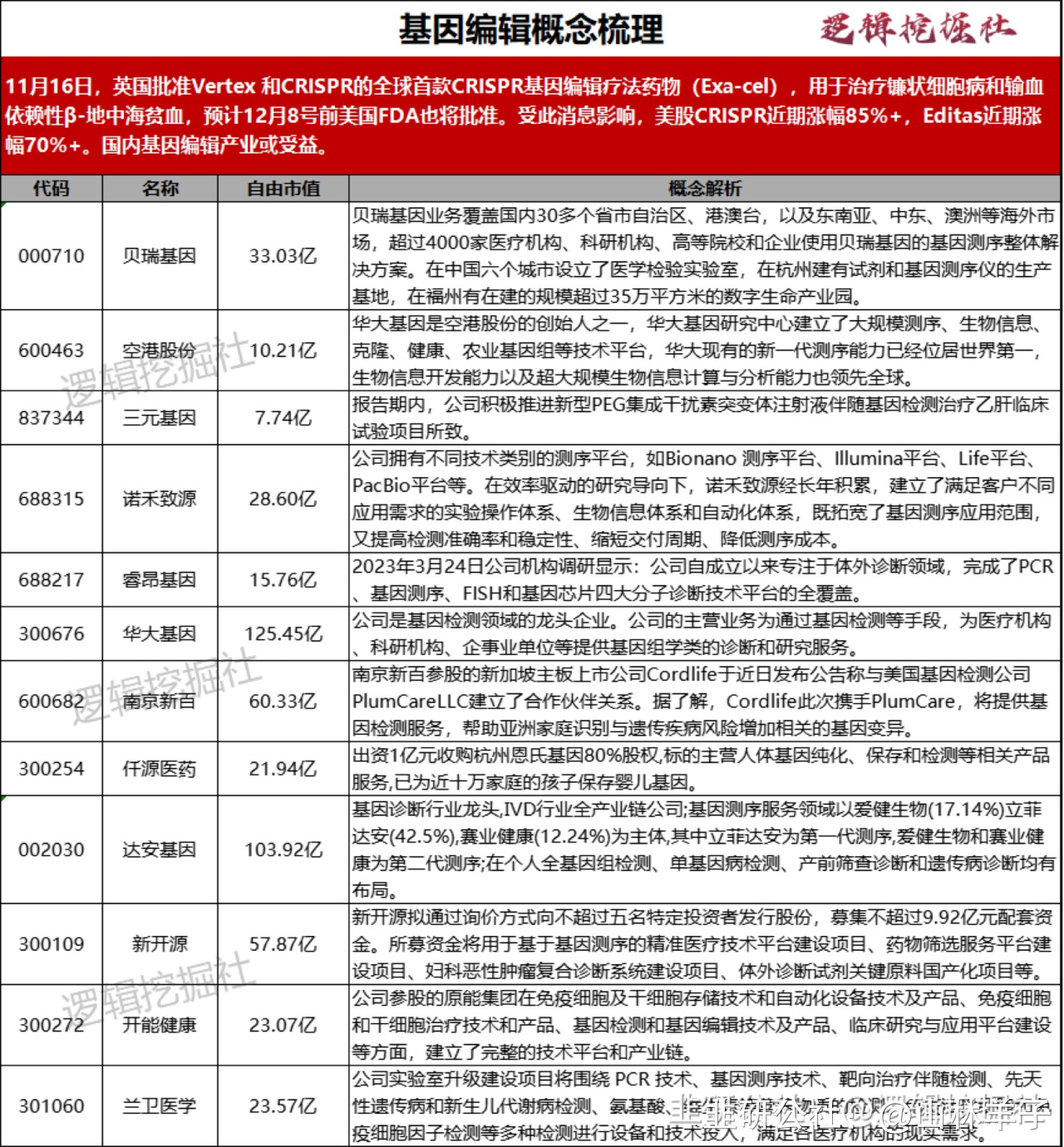
基于CRISPR疗法面临伦理压力,之前基因编辑相关疗法商业化道路一直坎坷,本次英国批准基因编辑疗法药物商用,标志着该疗法在商用层面的重大突破,也给后续采取类似技术路线的药物开辟道路。
英国一直是基因工程的前沿国家,早在20多年前,克隆羊多利便是由英国威尔穆特的团队“制造”出的,而我国在基因编辑以及基因工程领域的研究多处于实验室阶段,能够商用的条件不成熟,但由于产业出现突破性事件,未来相关领域的研发和商用进展有望超预期加速。
今天分享的标的是香雪制药(300147):
公司开发的针对软组织肉瘤的TCR-T疗法-TAEST16001,是中国首个获得IND批件的TCR-T细胞免疫治疗产品。在2022ASCO年会上,香雪制药公布了TAEST16001的I期临床结果,数据显示,肿瘤客观缓解率(ORR)达到41.7%,其安全性和有效性的临床研究结果与同场作口头报告的GSK同靶点产品的临床结果相当,目前已在中国启动II期临床研究(2023年初开始Ⅱ期临床)。
国内布局 TCR-T疗法的公司有立凌制药、可瑞生物、复星凯特、药明巨诺、金斯瑞生物科技、深圳因诺免疫,香雪制药,来恩生物、天科雅、广州泛恩生物等。
公司核心决策层在10年前就搭建了团队,在精准医疗技术上布局,成为全球第二家开展高亲和性T细胞受体平台技术、基因治疗技术的研发机构,是国际上唯一同时横跨TCR-T和TCR药物两大技术的公司。
目前,已有两个产品已在中国获得IND批件,其中第一个产品是TAEST16001,适应症为软组织肉瘤,目前正在进行II期临床研究;第二个产品是TAEST1901,适应症为原发性肝癌,即将启动I期临床研究。
TCR-T=基因编辑吗?——不等价,但是CRISPR/Cas9基因编辑技术的重要应用!
2022年第37届癌症免疫治疗学会(SITC)年会发表了一项I期研究结果,这项研究宣告了基因编辑技术在肿瘤细胞疗法上的应用,带来了全新概念的TCR-T疗法,利用CRISPR/Cas9基因编辑技术,改造患者自体的新抗原特异性T细胞受体(NeoTCR),完成基于个体化基因编辑的细胞疗法。该结果同样在11月10日在线发表在顶尖学术期刊Nature上。这项技术的诞生有望在肿瘤治疗领域开辟全新的道路。
为什么是TCR-T?
目前CAR-T疗法在血液瘤中的疗效已得到验证,目前全球已上市7款治疗血液瘤的CAR-T疗法(其中一款在国内上市),但在实体瘤中,由于可用抗原的稀缺性、肿瘤的异质性或肿瘤的免疫抑制一直效果不佳。
而TCR疗法被认为是治疗实体瘤的有效方式。
TCR疗法的市场空间?
首个获批的TCR疗法是Immunocore的Tebentafusp,于2022年1月获批上市,治疗葡萄膜黑色素瘤,2022年首年销额达1.41亿美元,今年Q1销额0.52亿美元。即单病种近10亿市场空间+40-50%的增速。
对标香雪制药当前的市值,当前IMCR市值160亿人民币左右,大约8xPS。按相对保守的测算,单病种TCR疗法100亿估值,香雪制药目前仅40亿估值,未能反映公司新药的价值,在基因编辑为代表的基因疗法加速落地的情况下,公司距离商业化最近,有望成为国内首家TCR-T疗法落地的药企。
————分界线————TCR疗法相关知识科普(补充)
1、TCR疗法的概念和发展
有关TCR疗法的概念,早在1986年就由巴塞尔免疫研究所的Michael Steinmetz博士提出。Michael Steinmetz博士将一个T细胞的 TCR 基因转移到另一个T细胞中,从而赋予第二个T细胞相同的抗原特异性,这是当今TCR疗法的祖先。不过,在TCR疗法的后续开发过程中,因为安全性等问题遭受过严重的挫折,导致进展缓慢。
2022年1月25日,FDA批准Kimmtrak(tebentafusp-tebn,IMCgp100)用于 HLA-A*02:01 阳性的无法切除或转移性葡萄膜黑色素瘤(mUM)成人患者。这是一种双特异性 gp100 肽-HLA 导向的CD3-T细胞接合剂。成为全球首个上市的TCR药。
TCR是T细胞表面的特异性受体,以非共价键与CD3结合,形成TCR-CD3复合物,通过识别并结合组织相容性复合物-多肽综合体(MHC)呈递的抗原,从而激活T细胞。另外MHC可将细胞内的蛋白分解后的片段呈现在细胞表面,TCR通过与MHC相结合来判断靶细胞是否正常,如果T细胞发现MHC呈现出的蛋白片段是变异的,就会杀死靶细胞。
TCR-T的作用机制就是向普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR,从而引导T细胞杀死肿瘤细胞。
过继性T细胞转移(ACT)是肿瘤治疗中最有前途的免疫治疗方法之一。目前有四种成熟的ACT技术,包括自体肿瘤浸润淋巴细胞(TIL)治疗、抗原特异性内源性T细胞治疗(ETC)、T细胞受体工程T细胞治疗(TCR-T)和嵌合抗原受体T细胞治疗(CAR-T)。TIL和ETC疗法分别依赖于从肿瘤或外周血中分离和体外扩增T细胞,而TCR-T和CAR-T疗法利用T淋巴细胞的基因修饰赋予它们肿瘤抗原特异性。
2、TCR-T疗法的流程
在技术流程上,TCR-T治疗大致上可以分为6个步骤:
①筛选和确定肿瘤上合适的特异性抗原,以及对抗原有高度特异性的TCR αβ链序列;
②从患者体内分离出T细胞;
③将TCRαβ序列包入病毒基因组,构建病毒载体;
④病毒转染T细胞,将目标TCR序列引入T细胞,从而获得特异性TCR-T细胞;
⑤TCR-T细胞体外培养、大量扩增;
⑥将数量合适的TCR-T细胞回输患者体内
3、个体化TCR-T疗法带来了什么
发表于SITC年会的I期研究使用的NeoTCR-P1 T细胞是用于治疗实体瘤患者的个体化TCR-T疗法。该疗法通过精准的基因工程技术,对新抗原TCR进行预测,随后使用预测 的新抗原HLA捕获试剂,从患者体内分离出T细胞,并基于CRISPR/Cas9非病毒精确基因组编辑技术,同时敲除两个内源性TCRα和TCRβ基因序列,直接将能精准识别肿瘤特异性抗原的TCR序列插入,从而完成个体化TCR-T细胞的改造。该技术较传统TCR-T疗法具有更为精准化个体化的治疗,并且因为不通过病毒载体编辑技术,从而减少安全上的隐患。



- 昭衍新药,国内最大也是首家开展基因编辑药物试验安评的公司,纯铲子股,所有基因编辑药物试验都过一手,美国还有两个实验室
 50打赏回复投诉于2023-11-21 18:55:03更新查看1条回复
50打赏回复投诉于2023-11-21 18:55:03更新查看1条回复
- 1
- 2
- 3